Comment agit le CO sur l’organisme?
Fixation sur l’hémoglobine du sang
Hémoglobine
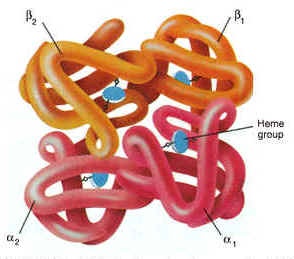
Chez l’homme, l’hémoglobine - pigment contenu dans les globules rouges du sang - assure le transport de l’oxygène depuis les poumons jusqu’aux cellules.
La molécule d’hémoglobine se compose de 4 chaînes polypeptidiques (globines) et contient 4 hèmes, chacun porteur d’un atome de fer (en bleu) sur lesquels se fixent les atomes d’oxygène.
L’affinité du CO pour l’hémoglobine est 210 à 260 fois plus forte que celle de l’oxygène. Même présent en quantité infime dans l’air, le CO se liera préférentiellement à l’hémoglobine du sang au lieu de l’oxygène.
- Situation normale: O2 + Hb → O2Hb (oxyhémoglobine).
- Présence de CO: CO + Hb → COHb (carboxyhémoglobine).
Le transport de l’oxygène est perturbé. L’oxygène n’arrive plus jusqu’au cellules qui sont en état d’hypoxie cellulaire.
La quantité de carboxyhémoglobine formée dépend:
- De la concentration de CO dans l’air.
- De la durée d’exposition.
- Du degré d’activité de la victime (plus l’effort physique est intense, plus la respiration est rapide et plus on inhale de CO).
- De l’état de santé de la victime (problèmes cardiaques, affections respiratoires).
La liaison du CO à l’hémoglobine n’entraîne pas seulement une baisse de la quantité d’oxygène transportée par molécule d’hémoglobine. Elle a également un effet indirect par déplacement de la courbe de dissociation de l’oxyhémoglobine.
En présence de CO, la courbe de dissociation de l’oxyhémoglobine en fonction de la pression partielle d’oxygène (pO2) se déplace vers la gauche. Le CO ne prend pas seulement la place de l’oxygène sur l’hémoglobine, il augmente également l’affinité de l’hémoglobine pour l’oxygène et diminue la délivrance d’oxygène au niveau des tissus. La pression partielle d’oxygène (pO2) dans les tissus périphériques doit s’abaisser plus fortement pour que l’hémoglobine libère son oxygène. Ce phénomène aggrave encore le manque d’oxygène au niveau des cellules.
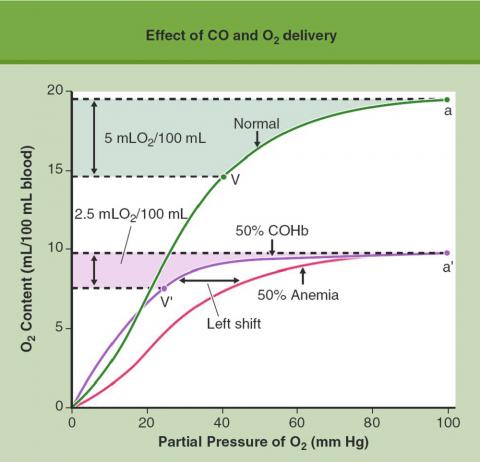
La figure ci-dessus illustre ce double mécanisme: en temps normal, le sang délivre aux tissus 5 ml d’oxygène par 100ml de sang lorsque la pression partielle d’oxygène chute de 60 mm de Hg (de a à V sur la courbe de dissociation de l’oxyhémoglobine).
En cas d’anémie où le nombre de globules rouges est divisé par deux (diminution de 50% de la capacité de transport), le sang ne délivre aux tissus que 2,5ml d’oxygène par 100ml pour une même chute de la pression partielle d’oxygène de 60 mm de Hg. Lors d’une intoxication au CO avec une carboxyhémoglobinémie de 50%, pour délivrer aux tissus 2,5ml d’oxygène/100ml de sang, il faut que la pression partielle d’oxygène chute de 75 mm de Hg (de a’ à V’).
Diffusion dans les tissus
Le CO gazeux se dissout également dans le plasma et pénètre sous cette forme dans les tissus alors que le CO lié à l’hémoglobine y reste fixé et n’arrive quasi pas au niveau cellulaire.
Dans les tissus, le CO se lie aux protéines musculaires (myoglobine). La myoglobine assure le transport d’oxygène dans le cœur et les muscles. La myoglobine a également une plus grande affinité (40x) pour le CO que pour l’oxygène. Comme pour l’hémoglobine, la courbe de dissociation de la myoglobine se déplace vers la gauche en présence de CO.
Dans les cellules, le CO se lie également à la cytochrome- C- oxydase, enzyme qui permet l’oxydation du cytochrome C dans la chaîne respiratoire mitochondriale. Si cette enzyme est bloquée, il y a développement d’un métabolisme anaérobie (sans oxygène) et production d’acide lactique.
Etant donné le blocage de la chaîne respiratoire mitochondriale, il y a production de radicaux libres oxygénés. Lors de la phase de réoxygénation, les radicaux libres oxygénés peuvent produire des lésions cérébrales par peroxydation des lipides membranaires. Ce mécanisme pourrait être à l’origine des lésions cérébrales tardives survenant après une intoxication grave au CO.
Le CO se fixe aussi sur le cytochrome P450 mais les répercussions pathologiques de ce phénomène ne sont pas encore bien connues.